Введение
Симптоматическое течение аутосомно-доминантной поликистозной болезни почек (АДПБП) резко ухудшает качество жизни больных хронической болезнью почек в терминальной стадии (тХБП). На сегодняшний день радикальным лечением пациентов данной группы и в рамках предтрансплантационной подготовки в отсутствие свободного места для гетеротопической пересадки донорской почки является билатеральная нефрэктомия (НЭ) нативных почек лапароскопическим, открытым или комбинированными доступами. Однако зачастую выполнение столь массивного оперативного лечения во многих центрах является вызовом как для хирурга, так и для пациента.
Также стоит сказать, что большое разнообразие послеоперационных осложнений после НЭ нативных почек значительно снижает шансы больных на проведение пересадки донорской почки в дальнейшем, поэтому на сегодняшний день в мире в нескольких центрах практикуется методика рентгеноэндоваскулярной трансартериальной эмболизации почек. Билатеральная трансартериальная эмболизация почечных артерий (ТАЭ) – эффективная и малоинвазивная техническая процедура, которая может использоваться в комбинированном лечении пациентов с АДПБП и тХБП.
Сочетанное применение билатеральной ТАЭ с последующей отсроченной билатеральной НЭ дает новые возможности в лечении пациентов с тХБП и АДПБП. Рассмотрение ТАЭ почек как альтернативной методики радикального лечения больных АДПБП с симптоматическим течением на сегодняшний день требует дополнительного изучения.
Обзор литературы
Доля пациентов с АДПБП в программах диализа и трансплантации на сегодняшний день составляет до 10% [1]. Проградиентное течение данного наследственного заболевания проявляется неизбежным злокачественным снижением функции почек вследствие кистозной трансформации почечной паренхимы. Кистозная дегенерация приводит к увеличению общего объема почек (ООП), что является современным прогностическим биомаркером скорости прогрессирования почечной недостаточности [2]. Долгое время бытовало такое мнение: у пациентов с тХБП на фоне начала заместительной почечной терапии происходит уменьшение почек, однако недавние работы показывают, что это на самом деле не так: даже на фоне проведения программного и перитонеального диализа выраженного уменьшения почечного объема не происходит, однако Yamamoto и соавт. сообщили, что ООП снижается после трансплантации почки. Большее снижение ООП у пациентов с лучшей посттрансплантационной функцией почек может быть обусловлено более эффективным устранением влияния уремии на пролиферацию канальцевого эпителия, более выраженным снижением притока крови к нативным почкам и улучшением водной нагрузки [3].
Возникновение кист-ассоциированных симптомов (массэффект симптомов) резко ухудшает качество жизни больных данной группы. Выраженные боли в животе, связанные с ростом кист и сдавлением нервных окончаний в паренхиме почек, часто не удается контролировать даже при применении наркотических анальгетиков. Моторно-эвакуаторные нарушения дигестивного тракта проявляются увеличением окружности живота, ранним чувством насыщения, гастроэзофагеальным рефлюксом, дисфагией, вздутием живота, запорами, ишемическим колитом, кахексией, возникновением язв желудочно-кишечного тракта. Наблюдаются расстройства функции внешнего дыхания, связанные со сдавлением диафрагмы и как следствие – снижением объема форсированного выдоха за первую секунду форсированного выдоха (ОФВ1) и жизненной емкости легких (ЖЕЛ), возникновением хронической гипоксии и ортостаза [4].
Рецидивирующие кровоизлияния в кисты в некотором проценте случаев могут свидетельствовать об озлокачествлении кист. Развитие кистозной инфекции при тяжелом течении протекает с развитием синдрома системной воспалительной реакции (СИРС) вплоть до сепсиса. Наблюдается стойкое неподдающееся медикаментозной коррекции повышение артериального давления [5]. Нельзя не согласиться, что вышеописанные симптомы резко ухудшают качество жизни больных данной когорты.
Современное лечение пациентов с симптоматическим течением АДПБП направлено на то, чтобы избегать билатеральной НЭ нативных почек перед трансплантацией с целью сохранить продукцию эндогенного эритропоэтина, обмен витамина D и поддерживать лучшее качество жизни за счет устойчивой продукции мочи. Ранее предпринимались попытки малоинвазивного лечения данных пациентов, включившие применение пункционных методик, фенестрации и декортикации кист, однако они не нашли широкого применения в клинической практике и иногда не всегда эффективны, склонны к рецидивированию симптомов [6]. Однако стоит отметить, что на сегодняшний день нет и формального консенсуса, определяющего кандидатов на НЭ, а время, показания и доступ к данному вмешательству до сих пор дискутабельны [7].
Основным методом радикального лечения пациентов с симптоматическим течением АДПБП и в рамках предтрансплантационной подготовки в отсутствие свободного места для гетеротопической пересадки донорской почки остается билатеральная НЭ нативных почек лапароскопическим, открытым или комбинированным доступами. Данный вид лечения сопряжен с развитием массы осложнений: массивные кровотечения (требующие проведения гемотрансфузий, которые приводят к выработке аутоантител с последующими сложностями при подборе донора для пациента), тромбоз артерио-венозной фистулы (АВФ), связанный с перепадами давления во время длительного оперативного лечения, гиперкалиемия, которая возникает в связи с большим объемом хирургической травмы, послеоперационные грыжи, раневая инфекция, перфорация кишечника с развитием перитонита, удлинение хирургического койко-дня с длительным периодом послеоперационной реабилитации пациентов; также следует уточнить, что есть ряд условно «тяжелых» коморбидных пациентов, для которых выполнение столь агрессивного хирургического вмешательства может стать летальным.
За последние годы увеличилось число исследований, сообщающих о хороших результатах ТАЭ почечной артерии с целью симптоматического лечения АДПБП, особенно у коморбидных пациентов, которым выполнение радикальной НЭ противопоказано, или тем, кто отказывается от НЭ. По данным литературы, среднее уменьшение ООП и как следствие – уменьшение симптомов (уменьшение масс-эффекта) составили 42% через 3 и 54% через 6 месяцев наблюдения, а ТАЭ была успешной в 85% случаев [8].
ТАЭ почек применяется в медицинской практике уже с 1970-х гг. Сегодня метод широко используется для решения различных мультидисциплинарных клинических задач, таких как купирование макрогематурии, паллиативное лечение рака почки, предоперационная химиоэмболизация опухолей, лечение ангиомиолипом и сосудистых мальформаций [9]. Harley и соавт. впервые сообщили об использовании ТАЭ спиралью Джантурко–Уоллеса при лечении поликистоза почек в 1980 г. для остановки рецидивирующего кровотечения, которое привело к быстрому массивному увеличению почки и тяжелой неизлечимой анемии. В 1999 г. Ubara и соавт. сообщили о случае, когда размер увеличенной поликистозной почки был уменьшен за счет эмболизации почечных артерий. Процедура включила индуцирование тромбоза питающих артериол с помощью местных инъекций спирта, спиралей, ПВА, эмбосфер [10] или комбинации этих подходов.
Гистологическое исследование показало, что оставшийся интерстиций между кистами был замещен фиброзной тканью, но был хорошо васкуляризирован. По мере прогрессирования почечной недостаточности роль почечных артерий, по-видимому, смещается от поддержки функции почек к снабжению жидкостью множественных кист почек. При этом заболевании ангиогенез предположительно обеспечивается питающей артерией кисты. Так, Ubara и соавт. выдвинули гипотезу: процедуры, направленные на создание острой ишемии хорошо развитых почечных артерий, приводят к уменьшению почечных кист, а также замедлению неоангиогенеза. С тех пор подавляющее большинство зарегистрированных процедур ТАЭ для АДПБП было выполнено в Японии Ubara и его коллегами. Анализируя всевозможные публикации по данной теме, выявлен тот факт, что в западной медицинской культуре не принято проводить эту процедуру вместо хирургического вмешательства. Сам Ubara предположил, что эта разница может быть связана с более высокой частотой трансплантаций почек в западном мире, чем в Японии, где распространена в основном только родственная трансплантация. Таким образом, поликистозные почки на Западе удаляются во время трансплантации и там, где нет необходимости в ТАЭ. Вероятнее всего, такое отношение к эмболизации связано с тем, что различные авторы пытаются противопоставить ТАЭ почек билатеральной НЭ в качестве самостоятельного метода лечения. Они утверждают, что односторонняя нативная НЭ перед трансплантацией почек была связана с самым быстрым освобождением места для трансплантата и низкой частотой возникновения послеоперационных осложнений и, по-видимому, является предпочтительной стратегией. Артериальная эмболизация уменьшает объем почек на 49% через 6 месяцев и может быть рассмотрена, когда уменьшение размера выбранной почки не является неотложной ситуацией [11]. В этом смысле любопытны исследования Bendavid и соавт., которые использовали ТАЭ почек перед НЭ для снижения риска геморрагических осложнений, однако оперативное лечение выполнялось день в день после эмболизации, при такой модели оценить контрактильный эффект (уменьшение ООП) не представляется возможным. В 2002 г. в отчете Ubara и соавт. описали 64 пациента, получивших ТАЭ почек. Было использовано от 16 до 40 платиновых и стальных спиралей (в среднем 31,2 спирали). Размеры почек уменьшились до 73,8%, 61,7 и 53,4% от доинтервенционных значений через 3, 6 и 12 месяцев после терапии соответственно [12]. До объективного подтверждения уменьшения размера почек с помощью диагностической визуализации у большинства пациентов наблюдалось облегчение таких симптомов, как вздутие живота, дисфагия и снижение перорального приема пищи, в течение 1–2 недель, все пациенты испытывали облегчение симптомов в течение 1 месяца [13].
Помимо вышеуказанных есть ряд других публикаций, также демонстрирующих неплохие результаты применения методики ТАЭ для уменьшения объема почек. Petitpiere и соавт. (использовали поливинил алкоголь – ПВА и этанол) отметили уменьшение объема почек на 40% через 3 месяца, Suwabe и соавт. (использовали платиновые микроспирали) отметили уменьшение объема почек на 31,4%, 38,2, 46,5% через 3, 6, 12 месяцев соответственно, Sakuhara и соавт. (использовали этанол) – на 60,9%, 47,3, 38,8% через 3, 6, 12 месяцев соответственно. Этанол вызывает полную гибель клеток с тотальной окклюзией сосудов и некрозом периваскулярных областей, что позволяет избегать поздней реваскуляризации коллатеральными сосудами. Сокращение кистозного объема этанолом происходит за счет некроза периваскулярных областей из-за обширной капиллярной сети в стенке поликистозной почки. В целом эмболизация почек этанолом может быть безопасно выполнена, но сообщалось о редких осложнениях, таких как инфаркт яичка или толстой кишки. Эти зарегистрированные осложнения могут быть вызваны рефлюксом введенного этанола. Для предотвращения этого осложнения используется окклюзионный баллонный катетер [14]. Следует также сказать, что, согласно обзору исследований на тему эмболизирующих агентов, используемых при ТАЭ почек независимо от используемого агента эмболизации, все исследования продемонстрировали аналогичный успех в уменьшении объема почек.
Ubara утверждает, что ТАЭ является вариантом лечения пациентов с почечной паренхиматозной инфекцией или кистозной инфекцией, об этом свидетельствует ряд публикаций [15], однако, по нашему мнению, выполнение эмболизации на фоне активного течения инфекции мочевых путей и нагноения кист следует считать опасным, т.к. отсутствие кровотока в почке полностью нивелирует использование консервативной антибактериальной терапии. Об этом свидетельствует наблюдение А.Е. Лубенникова: выполнение билатеральной НЭ в отсроченном периоде после длительного курса (более 14 дней) антибактериальной терапии на фоне СИРС с уровнем С-реактивного белка (СРБ) более 90 мг/л ассоциировалось с высокой вероятностью летального исхода после вмешательства [16].
К признакам клинической эффективности ТАЭ почек относятся снижение симптомов компрессии, снятие противопоказаний к трансплантации, улучшение легочной функции. Эмболизация почечных артерий считается безопасной процедурой с относительно низким уровнем осложнений и неплохими результатами в виде улучшения качества жизни пациентов. Наиболее частым побочным эффектом ТАЭ является постэмболизационный синдром (ПЭС), которым страдают более 90% пациентов. У них обычно отмечаются легкие боли в боку (проходят в среднем в течение 5 дней), лихорадка (исчезает в среднем в течение 8 дней), тошнота, рвота, паралитическая кишечная непроходимость, лейкоцитоз, повышение уровней СРБ, лактатдегидрогеназы (ЛДГ) в течение 1–3 дней после ТАЭ с последующим снижением уровней воспалительных маркеров. Лечение синдрома поддерживающее, состоит из анальгетиков, жаропонижающих и противорвотных средств по мере необходимости до исчезновения симптомов – обычно в течение нескольких дней. Миграция спирали – крайне редкое, но потенциально серьезное осложнение, встречающееся менее чем в 2% случаев. Как правило, это обнаруживается в конце эмболизации и может быть устранено с помощью эндоваскулярного захвата (петли). Случайная нецелевая эмболизация может приводить к инфаркту позвоночника, нижних конечностей и кишечника. Рефлюкс материалов для эмболизации может способствовать потере почечной функции и последующей артериальной гипертензии, а непреднамеренное прохождение частиц через АВФ может приводить к легочной эмболии. Правильное и надежное расположение инъекционного катетера, возможно, с использованием временного баллонного окклюзионного устройства (окклюдера) в исходной артерии может снижать этот риск. Как и при любом чрескожном артериальном вмешательстве существует низкий риск гематомы в месте доступа, которая может быть уменьшена с помощью надлежащей техники ручной компрессии или закрывающих устройств. Наконец, контраст-индуцированная нефропатия может возникать после процедуры, особенно у пациентов с ограниченной функцией почек, и это следует учитывать при планировании лечения. Последующая визуализация может показать наличие внутрипочечного газа, но это не обязательно указывает на инфекцию.
Частота инфекций, связанных с ТАЭ, очень низкая. Однако важно дифференцировать ПЭС и инфекцию, развившуюся в раннем послеоперационном периоде. ПЭС продолжается до 72 часов, если же происходит нарастание уровней воспалительных маркеров в течение боле 3 суток, можно говорить о присоединении инфекционного процесса. Бактериологический посев крови и мониторинг жизненно важных показателей служат ключом к ранней идентификации сепсиса и улучшению исхода лечения пациента посредством раннего начала антибактериальной терапии или незамедлительному выполнению НЭ как сальважной процедуры в данном случае. Следует ожидать, что эмболизация приводит к некрозу тканей и образованию спаечного процесса, который может сделать последующую НЭ технически сложной задачей. В этом отношении обнадеживают Petitpierre и соавт. [17], которые описали восемь случаев, когда ТАЭ почек не смогли обеспечить достаточного успеха, но последующая НЭ проводилась без серьезных технических проблем. Лишь в некоторых случаях сообщалось о необходимости дополнительного чрескожного дренирования почек. Тем не менее важно понимать, что смертность и частота осложнений после ТАЭ статистически ниже, чем после билатеральной НЭ без предварительной ТАЭ [18].
Другие осложнения почечных TAЭ, такие как абсцесс почки, эмфизематозный пиелонефрит или образование сосудистой мальформации, формально не были оценены ни в одном из исследований.
К недостаткам ТАЭ можно отнести то, что любая остаточная почечная функция будет устранена в результате острого сосудистого некроза (инфаркта почки). Кроме того, инфаркт почки может вызывать снижение гематокрита. Основными причинами неэффективности ТАЭ почек были большой базальный объем почек [19], пропущенные добавочные почечные артерии [20] и возраст [21]. Однако даже в отсутствие этих критериев не всегда удается достигать желаемого результата. В небольшом числе исследований TAЭ почек была более эффективной у молодых пациентов, которые имели более короткую продолжительность диализа или длительный анамнез течения артериальной гипертензии, параметры, которые можно связать с жесткостью стенки кисты и кровотоком в почечной артерии. Утолщение стенки кисты (ее жесткость) может иметь большее влияние на скорость уменьшения кист, чем их диаметр, но данный тезис требует дополнительного патоморфологического исследования [22].
Согласно систематическому обзору и мета-анализу [23], ТАЭ почечных артерий может использоваться в качестве альтернативы НЭ. ТАЭ почек – малоинвазивный метод лечения, который хорошо переносится пациентами и имеет небольшое число осложнений. В этом систематическом обзоре эффективность TAЭ рассматривается как вариант уменьшения симптомов компрессии органов брюшной полости из-за увеличенных почек и их размера перед трансплантацией с целью освобождения места в полости таза. В исследовании, проведенном Akabane и соавт., выявлено, что пациенты, которые подвергались НЭ нативных почек с предоперационной билатеральной ТАЭ, имели лучшую функцию почечного трансплантата в послеоперационном периоде, чем у любой другой группы. Однако если таз реципиента имеет достаточное пространство, НЭ не нужна, поскольку объем почек уменьшается после трансплантации примерно на 25%, а совместно с ТАЭ эти значения могут быть на порядок выше [24].
При оценке эффективности методики ТАЭ почек обращает на себя внимание опыт отечественных коллег по применению рентгеноэндоваскулярной эмболизации артерии нефункционирующего трансплантата почки, выполненной на этапе предоперационной подготовки пациента к трансплантатэктомии, что позволило уменьшить интраоперационную кровопотерю, сократить продолжительность хирургического вмешательства, выполнить его в более благоприятных условиях и тем самым минимизировать риск развития интраи ранних послеоперационных осложнений. Особенно это показано при активном отторжении почечного трансплантата в отдаленные сроки после операции [25].
Текущие исследования показывают, что ТАЭ почек является успешным и минимально инвазивным вариантом для уменьшения объема почек в рамках предтрансплантационной подготовки в отсутствие достаточного места для донорской почки, а также с целью предотвращения различных послеоперационных осложнений и облегчения масс-эффект симптомов, вызванных выраженной нефромегалией. Однако из-за неоднородности используемых материалов для эмболизации и отсутствия четко определенных факторов, ведущих к неудаче ТАЭ почек, в настоящее время остается неясным вопрос о рассмотрении данной методики как самостоятельной или же некоей альтернативы билатеральной НЭ, хотя в некоторых исследованиях выявлены положительные результаты комбинации рентгенэндоваскулярной методики и НЭ. Для решения данной задачи необходимы дальнейшие многоцентровые хорошо спланированные проспективные исследования, изучающие использование ТАЭ для пациентов с симптоматическим течением АДПБП.
Материал и методы
При написании данной статьи использованы сведения о применении ТАЭ почек для лечения пациентов с симптоматическим течением АДПБП, опубликованные в базах PubMed (https://www.ncbi.nlm.nih.gov/pubmed/), Научной электронной библиотеки РФ – Elibrary.ru (https://elibrary.ru/) и на сайтах профессиональных урологических и нефрологических ассоциаций. Поиск в базах данных проводили по ключевым словам: ADPKD, TAE, coils, embolic agents, kidney cysts, nephrectomy, infected kidney cysts, RRT. На первом этапе найдено 37 источников не старше 5 лет, включая систематические обзоры и мета-анализы, которые имели отношение к данной тематике. Из них исключены тезисы конференций, короткие сообщения, дублирующиеся публикации. После чего, исходя из актуальности данных, достоверности источников, импакт-факторов журналов и последовательности изложения материала в рукописи, непосредственно для цитирования в статье отобрано 25 статей из научных международных рецензируемых журналов, практических руководств и клинических рекомендаций.
Практическая часть работы основана на анализе результатов лечения 12 пациентов, которые находились на лечении в урологическом отделении ГБУЗ ГКБ № 52 ДЗМ с 01.11.2022 по 01.05.2023. Пациенты с тХБП на фоне АДПБП с симптоматическим течением поликистоза были рандомизированы в две группы. В первой группе (6 человек) за 3 месяца до выполнения лапароскопической билатеральной НЭ выполнена билатеральная ТАЭ почек (одним рентгенэндоваскулярным хирургом) с целью редукции объема и избавления от симптомов, а также предотвращения риска геморрагических осложнений, т.к. все пациенты находились на программном гемодиализе в течение длительного времени. Пациентам второй группы (6 человек) была выполнена лапароскопическая билатеральная НЭ без предварительной эмболизации. Все 12 нефрэктомий были выполнены опытным хирургом в одном хирургическом центре. Проведен сравнительный анализ разделения групп по гендерной принадлежности, возрасту, стартовому общему объему почек, процентной редукции ООП после эмболизации, продолжительности НЭ у пациентов с/без предварительной эмболизации, объему интраоперационной кровопотери, частоте тромбоза АВФ, гиперкалиемии, развитию гнойно-септических осложнений в раннем послеоперационном периоде, по продолжительности койко-дня, а также в динамике прослежено изменение уровня воспалительных маркеров крови после эмболизации (см. таблицу).
При выполнении работы использовались данные лабораторных и инструментальных исследований, включая компьютерную (КТ) и магнитно-резонансную томографию (МРТ) с использованием протоколов диффузионно-взвешенных изображений, морфологических исследований удаленных препаратов, видеопротоколы операций. Полученные результаты подвергались статистической обработке.
Все пациенты перед выполнением ТАЭ почек и билатеральной лапароскопической НЭ проходили тщательное обследование с консультацией смежных специалистов (анестезиолог-реаниматолог, нефролог, терапевт). Все пациенты имели те или иные симптомы течения АДПБП (боли в животе и спине, увеличение окружности живота, похудение, анамнез кровоизлияний в кисты, хроническое течение пиелонефрита, затрудненное дыхание в связи со сдавлением почками диафрагмы, в связи с этим наличие противопоказаний к трансплантации почки из-за отсутствия свободного места для трансплантата в полости малого таза). В рамках предоперационной подготовки пациентам выполняли мультиспиральную компьютерную томографию (МСКТ) органов забрюшинного пространства с внутривенным контрастированием с целью оценки сосудистой анатомии почек и/или МРТ почек с использованием протоколов диффузионно-взвешенных изображений с целью исключения инструментальных признаков активного течения кистозной инфекции или пиелонефрита. Расчет общего объема почек проводили на основании калькулятора клиники Мейо (ортогональном измерении основных характеристик почек: длина, ширина, толщина) для дальнейшей оценки эффективности ТАЭ почек. Лабораторный контроль (общий анализ крови – ОАК, общий анализ мочи – ОАМ, креатинин, мочевина, ЛДГ, СРБ, аланинаминотрансфераза – АЛТ, аспартатаминотрансфераза – АСТ, щелочная фосфатаза – ЩФ, γ-глютаматтранспептидаза – ГГТ, бактериологический посев крови, бактериологический посев мочи). Всем пациентам независимо от предполагаемой операции (ТАЭ или НЭ) за сутки проводили сеанс заместительной почечной терапии с оценкой уровней креатинина, мочевины, калия крови.
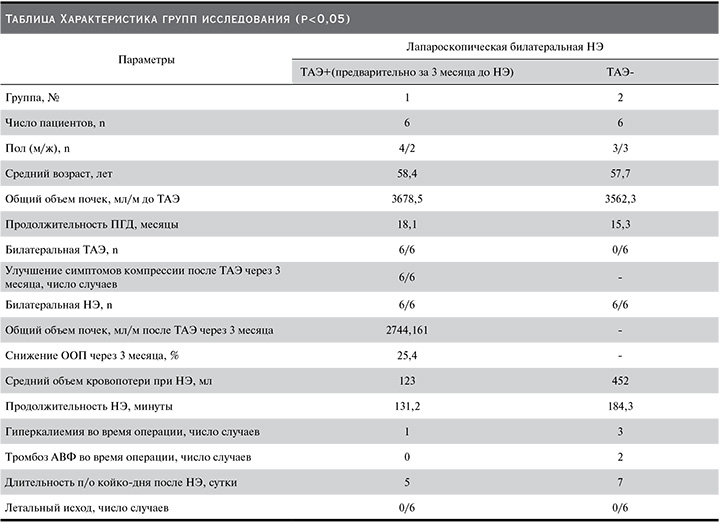
Больным первой группы (пациенты с предварительной билатеральной ТАЭ почек) с целью профилактики ПЭС непосредственно перед операцией в/в вводили антибактериальный препарат (амоксициллин 1000 мг+сульбактам 1000 мг), в/в дексаметазон 1 мл (4 мг/мл), в/в ингибитор протонной помпы эзомепразол 40 мг/1 фл. Также с целью более тщательного контроля анальгезии врачом-анестезиологом выполнялась в условиях рентгенэндоваскулярной операционной установка эпидурального катетера с инфузионной помпой для пролонгированного введения анестетика (ропивакаин 2 мг/мл 5 ампул по 10 мл) в течение 2–3 суток (в зависимости от выраженности болевого синдрома, рис. 3).
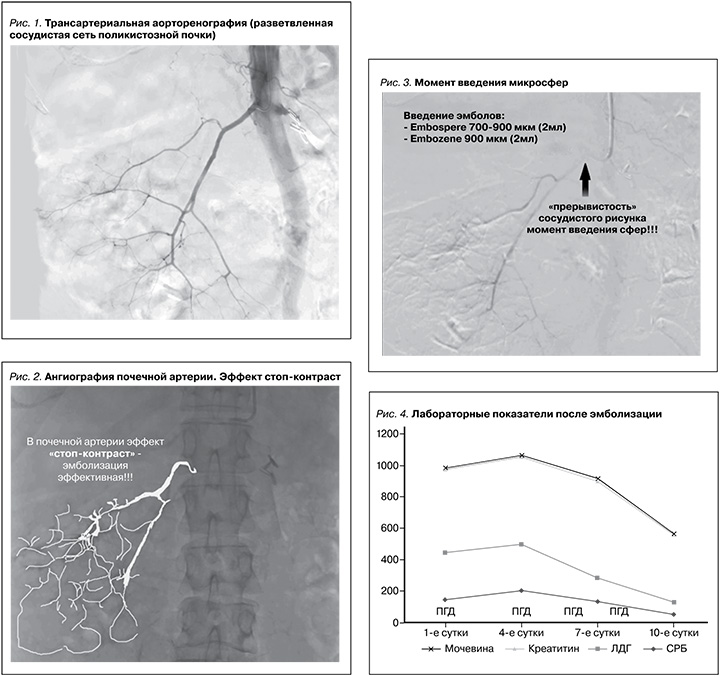
Описание операции. Операция проводилась под местной анестезией Sol. Lidocaini 2,0–10 мл. Правосторонним бедренным доступом пунктирована правая бедренная артерия (по методике Сельдингера). Последовательно катетеризированы правая и левая почечные артерии. Выполнена ангиография, при которой визуализированы растянутые и деформированные сегментарные почечные артерии с периферическими ветвями, окружающими кисты, что является характерным рентгенологическим признаком АДПБП (рис. 1).
При хроническом заболевании пересаженной почки или при терминальной стадии почечной недостаточности почечные артерии могут быть резко сужены, что предрасполагает к рефлюксу эмболизирующего материала в аорту. Именно по этой причине катетеры с временной баллонной окклюзией могут быть расположены в проксимальном отделе главной почечной артерии, чтобы избежать данного осложнения. Технической конечной точкой является наблюдение стаза контраста или медленного возвратно-поступательного потока в основной почечной артерии после завершения ангиографии (эффект стоп-контраст, рис. 2). Последовательно выполнена селективная тотальная эмболизация почечных артерий с обеих сторон введением микросфер Embosphere 500–700, Embosphere 700–900 (MeritMedical. BioSphere Medical S.A.) в каждую почечную артерию для эмболизации дистальных и проксимальных отделов артерии под тщательным рентгеноскопическим контролем (рис. 3) рефлюкса эмболизата.
При контрольной ангиографии левая и правая почечные артерии контрастировались на расстоянии от устья не более 2–3 см, далее – эффект стоп-контраста (рис. 2). По окончании эмболизации инструменты были удалены. Гемостаз. Асептическая давящая повязка. Снятие повязки через 12 часов. Билатеральная эмболизация почечных артерий выполнена всем больным без технических трудностей.
Пациент был переведен в палату для круглосуточного динамического наблюдения за основными витальными показателями, лабораторным контролем (ОАК, ОАМ, креатинин, мочевина, ЛДГ, СРБ, АЛТ, АСТ, ЩФ, ГГТ, бактериологический посев крови, бактериологический посев мочи) на 1-е, 3, 7-е сутки после эмболизации (рис. 4).
При нормализации состояния пациент выписан на 7–8-е сутки наблюдения. Через 3 месяца была осуществлена повторная плановая госпитализация в стационар для выполнения билатеральной лапароскопической НЭ с предварительным выполнением МСКТ почек с оценкой ООП (степень уменьшения объема нативных почек).
Второй группе больных (пациенты без предварительной билатеральной ТАЭ) была выполнена билатеральная лапароскопическая НЭ по стандартной в клинике методике. Все операции проводились одним опытным хирургом с видеофиксацией операций.
Результаты и их обсуждение
При пересмотре видеоматериалов пациентам, которым предварительно перед НЭ была выполнена билатеральная ТАЭ, на фрагменте показан просвет почечной артерии с тугим заполнением сферами (рис. 5).
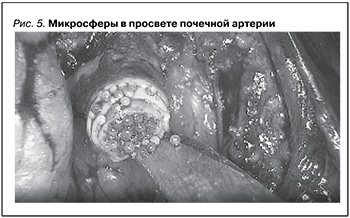
Во время операции также обратило на себя внимание полное отсутствие кровотока по почечным артериям, что конечно же облегчило выполнение хирургического вмешательства при отличной визуализации операционного поля. Весь операционный материал после билатеральной нефрэктомии был подвергнут морфологическому исследованию. При микроскопическом исследовании в просвете почечных артерий базофильное инородное содержимое глыбчатого вида (эмболы). Отмечались запустевание сосудов, сморщивание кист, некротические изменения остатков паренхимы и стромы.
Таким образом, комбинированное использование ТАЭ почек перед предстоящей билатеральной НЭ способствовало уменьшению симптомов компрессии в 100% случаев, т.к. стартовый объем почек уменьшался после процедуры ТАЭ в среднем на 25,4% в течение 3 месяцев. Данное обстоятельство позволило планировать оперативное лечение пациентов в плановом порядке с адекватной предоперационной подготовкой.
Оперативное пособие пациентов с предварительным выполнением ТАЭ почек существенно снизило время операции, в связи с этим мы не наблюдали тромбоза АВФ у пациентов, риск гиперкалиемии существенно снизился, также отмечено клинически значимое уменьшение объема кровопотери, что предотвращает риски геморрагических осложнений и выработку аутоантител при возможном переливании донорской крови. У пациентов, которым была выполнена ТАЭ, в связи с меньшим объемом хирургической травмы уменьшился послеоперационный койко-день, также в раннем послеоперационном периоде происходила активизация в среднем на 1–2 дня раньше, что улучшает экономические результаты лечения таких пациентов. Ни в одном из случаев за 3 месяца наблюдения после ТАЭ не возникло необходимости в экстренном проведении НЭ.
Заключение
Показания к ТАЭ почек на сегодняшний день еще не установлены. Мы проводим почечную ТАЭ пациентам с анурией и получающим ПГД, у которых есть симптомы и которым требуется ТАЭ почек. Лапароскопия не подходит пациентам с перитонитом или после обширных абдоминальных операций; таким образом, почечная TAЭ показана этим пациентам.
В целом текущие исследования показывают, что TAЭ является успешным и минимально инвазивным вариантом уменьшения объема почек для требований трансплантации и облегчения симптомов компрессии, вызванных увеличенными почками. Из-за неоднородности используемых материалов для эмболизации и отсутствия факторов, ведущих к неудаче TAЭ, в настоящее время не существует принципов для использования TAЭ в качестве альтернативы НЭ, основанных на фактических данных. Дальнейший большой размер выборки, многоцентровые проспективные исследования, изучающие использование TAЭ при АДПБП, необходимы, прежде чем можно будет получить результаты на основе фактических данных.
Эмболизация почечных артерий стала эффективным, универсальным и малоинвазивным средством при многих урологических состояниях, как острых, так и хронических. Его можно успешно применять для улучшения предоперационного ведения опухолей почки перед НЭ, достижения гемостаза в случаях кровоизлияния в результате травмы или опухолей, таких как ангиомиолипомы, лечения осложнений трансплантации почки и биопсии, таких как АВФ и псевдоаневризмы, улучшения симптомов у пациентов с артериовенозными мальформациями и некоторыми хроническими паренхиматозными заболеваниями почек, а также для лечения аневризм почечных артерий. В зависимости от показаний и характера поражения следует использовать различные эмболические материалы и катетеры для оптимизации результатов. Предоперационное планирование и тщательное внимание в случае осложнений во время и после процедуры должны быть выполнены для оптимального лечения пациентов. По мере совершенствования технологий и методов показания к ТАЭ могут расширяться, что делает важным понимание разнообразия доступных методов. Сочетанное применение билатеральной ТАЭ почечных артерий с последующей отсроченной билатеральной НЭ дает новые возможности в лечение пациентов с тХБП и АДПБП. Однако до сих пор нет исследований, демонстрирующих результаты длительного наблюдения за пациентами после ТАЭ, которые бы показали выраженный контрактильный эффект данной процедуры, который бы позволил считать данный метод лечения самостоятельным.



